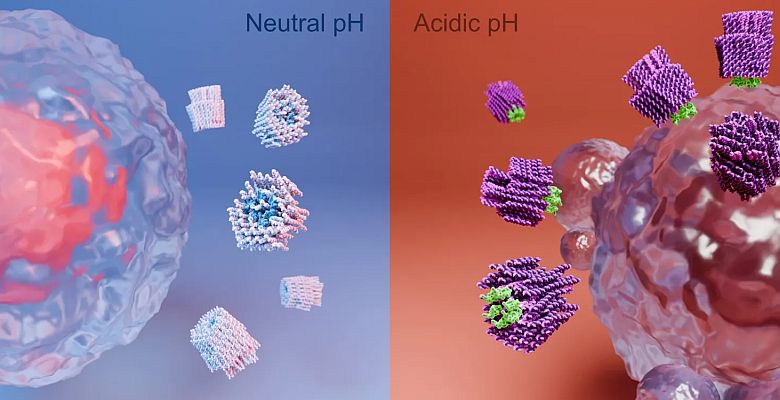
Het wapen van de nanorobot kan alleen worden blootgesteld in de zure omgeving die zich in en rond een solide tumor bevindt.
Onderzoekers van het Karolinska Institutet in Stockholm hebben nanorobots ontwikkeld die kankercellen bij muizen doden. Het wapen van de robot is verborgen in een nanostructuur en wordt alleen zichtbaar in de micro-omgeving van de tumor, waardoor gezonde cellen worden gespaard.
De onderzoeksgroep van het instituut heeft eerder structuren ontwikkeld die zogenaamde doodsreceptoren op het oppervlak van cellen kunnen organiseren, wat tot celdood kan leiden. De structuren vertonen zes peptiden (aminozuurketens), geassembleerd in een hexagonaal patroon. Dit nanopatroon van peptiden wordt een dodelijk wapen. Toegdiend als medicijn zou het zonder onderscheid cellen in het lichaam gaan doden, wat niet goed zou zijn. Om dit probleem te omzeilen, hebben de onderzoekers het wapen verborgen in een nanostructuur, opgebouwd uit DNA.
Kill switch
De kunst van het bouwen van structuren op nanoschaal met behulp van DNA als bouwmateriaal wordt DNA-origami genoemd. Het onderzoeksteam in Stockholm werkt hier al vele jaren aan. Nu hebben ze de techniek gebruikt om een 'kill switch' te creëren die onder de juiste omstandigheden wordt geactiveerd.
Ze zijn erin geslaagd het wapen zo te verbergen dat het alleen kan worden blootgesteld in de omgeving die zich in en rond een solide tumor bevindt. Dit betekent dat ze een soort nanorobot hebben gemaakt die zich specifiek op kankercellen kan richten en deze kan doden.
De sleutel is de lage pH of zure micro-omgeving die gewoonlijk kankercellen omringt, die het wapen van de nanorobot activeert. In celanalyses in reageerbuizen konden de onderzoekers aantonen dat het peptidewapen bij een bijna neutrale pH van 7,4 verborgen zit in de nanostructuur, maar dat het een drastisch celdodend effect heeft als de pH daalt naar 6,5.
Verminderde tumorgroei
Vervolgens testten de onderzoekers het injecteren van de nanorobot in muizen met borstkankertumoren. Dit resulteerde in een vermindering van de tumorgroei met 70%, vergeleken met muizen die een inactieve versie van de nanorobot kregen. Ze moeten nu onderzoeken of dit werkt in geavanceerdere kankermodellen die beter lijken op de echte menselijke ziekte. Ze moeten ook uitzoeken welke bijwerkingen de methode heeft voordat deze op mensen kan worden getest.
Ook willen ze onderzoeken of het mogelijk is om de nanorobot doelgerichter te maken door eiwitten of peptiden op het oppervlak te plaatsen die zich specifiek binden aan bepaalde soorten kanker.
De wetenschappelijke publicatie vindt u hier.
Ill.: Boxuan Shen